Esta mañana han llegado a España las primeras dosis de la vacuna de Moderna. En torno a las ocho de la mañana, el camión que las transportaba desde Bélgica ha llegado al almacén del Ministerio de Sanidad en el centro de la península. El Gobierno ha anunciado que en los próximos días las vacunas serán distribuidas de forma equitativa entre las CCAA.
Se trata de 35.700 dosis, procedentes del almacén de la compañía en Bélgica y que han sido trasladadas por carretera hasta el almacén del centro de la península. Técnicos de la Agencia Española de Medicamentos han certificado esta mañana la entrega minutos después de su llegada al almacén. Según la planificación establecida por la compañía, esta primera remesa está formada por 357 cajas, con 100 dosis en cada caja.
Dosis
Entre mañana miércoles y el jueves, las vacunas se distribuirán de forma equitativa entre las comunidades autónomas, siempre que las condiciones climatológicas lo permitan.
El acuerdo con Moderna establece que la cifra de dosis irá aumentando progresivamente en próximas entregas hasta un total de 599.500 dosis en las próximas cinco semanas (hasta la tercera semana de febrero incluida).En concreto, está previsto que en la cuarta semana de enero lleguen 52.000 dosis más; en la primera semana de febrero, 127.900, y en la tercera semana de febrero, 383.900 dosis.
Autorizacion EMA
Después de que la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) recomendara el día seis de enero la autorización de comercialización condicional a la vacuna frente a la COVID-19 desarrollada por la compañía estadounidense Moderna, el Ministerio de Sanidad anunció la semana pasada que a partir de esta semana empezarían a llegar las 600.000 dosis de la vacuna de Moderna dirigidas a inmunizar a 300.000 personas.
Este medicamento, que previene la enfermedad causada por el SARS-CoV-2 en personas a partir de los 16 años, es la segunda vacuna en obtener una autorización de comercialización condicional en la Unión Europea, tras la desarrollada por BioNTech/Pfizer.
Evaluación científica
El Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la EMA, formado por expertos de las autoridades competentes de los diferentes Estados Miembros de la UE, entre ellos la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), ha completado su evaluación científica concluyendo por consenso que dispone de datos suficientemente sólidos sobre la calidad, seguridad y eficacia de la vacuna para recomendar una autorización de comercialización condicional. Es decir, que el balance beneficio-riesgo en el que se basa la evaluación de cualquier medicamento, es positivo.
Al igual que con el resto de medicamentos autorizados por procedimiento centralizado, como sucedió el pasado 21 de diciembre con Comirnaty de BioNTech y Pfizer, la Comisión Europea será la encargada de otorgar la autorización para que la vacuna desarrollada por Moderna pueda distribuirse en todos los Estados miembro de la UE.
Autorización provisional
La autorización de comercialización condicional es un instrumento contemplado en la legislación europea. Permite una autorización ante una necesidad médica no cubierta, en la medida en que el beneficio para la salud pública de su inmediata disponibilidad es superior a la incertidumbre derivada de la limitación de los datos disponibles. Este tipo de autorización no es específica para esta situación; se ha concedido fuera y dentro de la pandemia y requiere de más datos que una autorización para situaciones de emergencia como la que se concede en otras regiones regulatorias.
La autorización de la vacuna de Moderna se basa en un ensayo clínico pivotal doble-ciego (se administra la vacuna o un placebo enmascarados de manera que se impida su identificación a simple vista), aleatorizado, frente a placebo que incluyó a más de 30.000 adultos mayores de 18 años que fueron vacunados con dos dosis de 100 microgramos, separadas por un intervalo de 28 días. En el análisis intermedio de los resultados se observaron 196 casos de enfermedad por coronavirus, 185 con placebo y 11 con la vacuna, lo que permitió estimar una eficacia vacunal del 94,1%.
¿Cómo es la vacuna de Moderna?
La vacuna de la biotecnológica Moderna se llama «mRNA-1273» y se basa en ARN mensajero. ¿Qué quiere decir esto? La vacuna de Moderna introduce un ARN mensajero del virus (ARNm) en el cuerpo para que las células humanas lo recojan y luego lo utilicen para crear un fragmento de una partícula viral de SARS-CoV-2 que no causa la infección, pero sería suficiente para que el sistema inmunológico lo reconozca como antígeno extraño. El sistema inmunológico aprende a reconocer ese fragmento y a responder a él. De esta manera, si el verdadero virus SARS-CoV-2 llega al cuerpo, el sistema inmunológico es capaz de responder a él antes de que ocurra una infección completa.
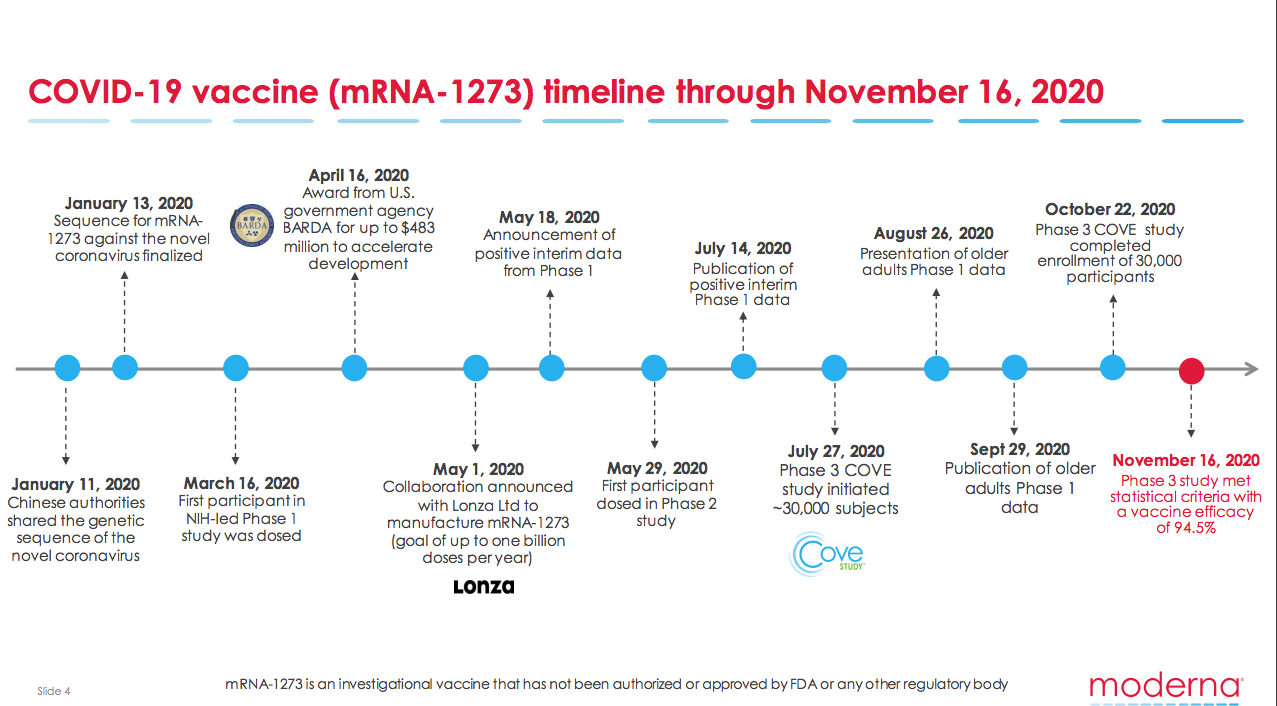
La eficacia anunciada por la compañía en fase tres es del 94,1%.
La vacuna de Moderna necesita estas condiciones de refrigeración:
- Puede estar a -20 grados centígrados durante seis meses (condiciones de distribución).
- Entre 2-8 grados durante un mes (pensado para el momento en que ya se encuentra en centro de salud)
- Temperatura ambiente, 12 horas (momento de administración)
Moderna ha afrontado la fase 3 con hasta 30.000 voluntarios de 89 lugares de Estados Unidos.